Itovebi® (inavolisib) – cílený zásah na PIK3CA mutaci už v 1. linii HR+/HER2– mBC
Evropská komise nově schválila Itovebi® (inavolisib), selektivní inhibitor PI3Kα v této indikaci1:
Přípravek Itovebi v kombinaci s palbociklibem a fulvestrantem je indikován k léčbě dospělých pacientů s estrogen‑receptor (ER) pozitivním, HER2 negativním, lokálně pokročilým nebo metastazujícím karcinomem prsu s mutací genu PIK3CA po relapsu během adjuvantní endokrinní léčby nebo do 12 měsíců od jejího dokončení1. Je třeba, aby pacienti dříve léčení inhibitorem CDK 4/6 v (neo)adjuvantním režimu, měli interval alespoň 12 měsíců mezi ukončením léčby inhibitorem CDK 4/6 a detekcí rekurence1. U pre/perimenopauzálních žen a u mužů je třeba kombinovat endokrinní terapii s agonistou luteinizačního hormonu (LHRH)1.
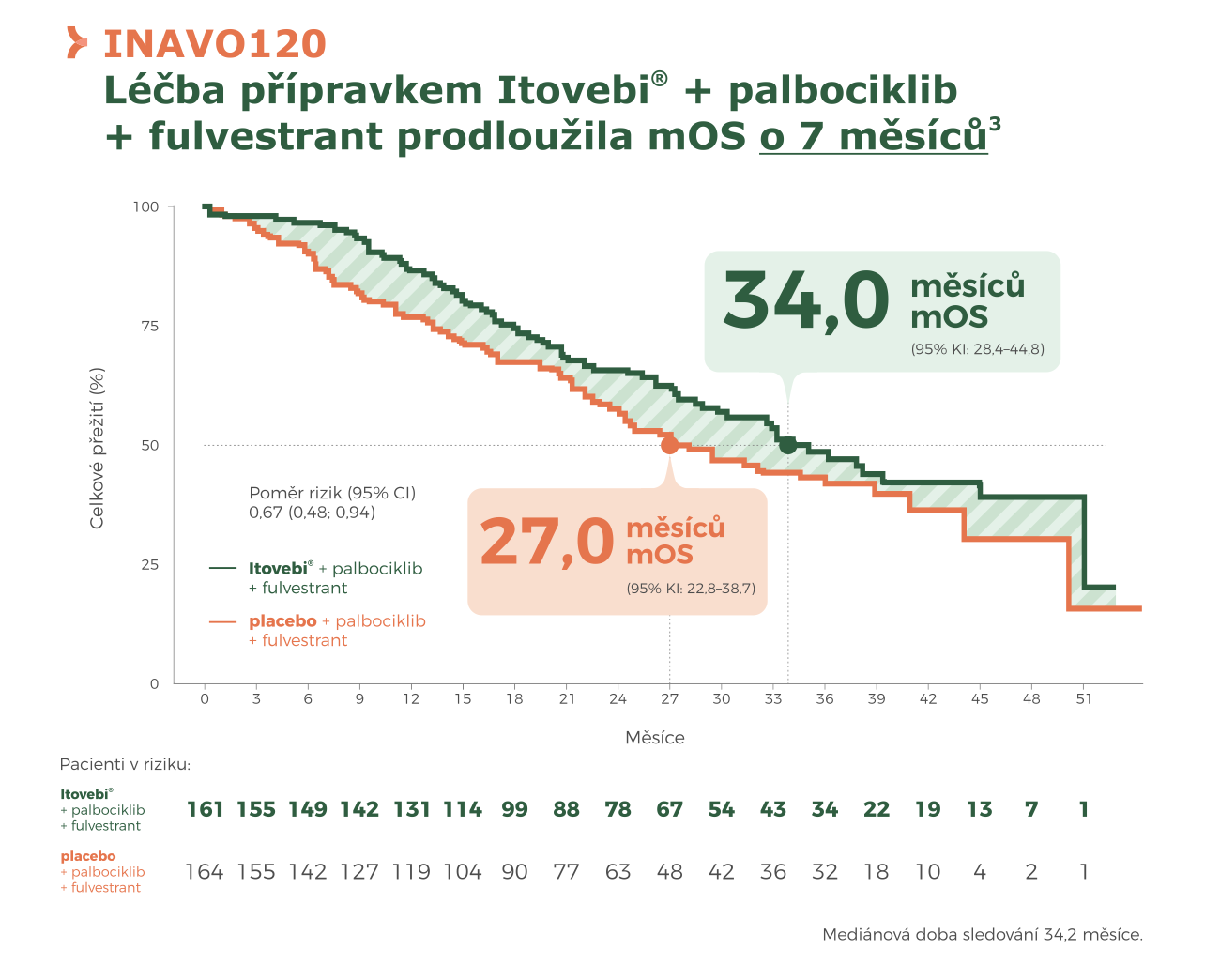
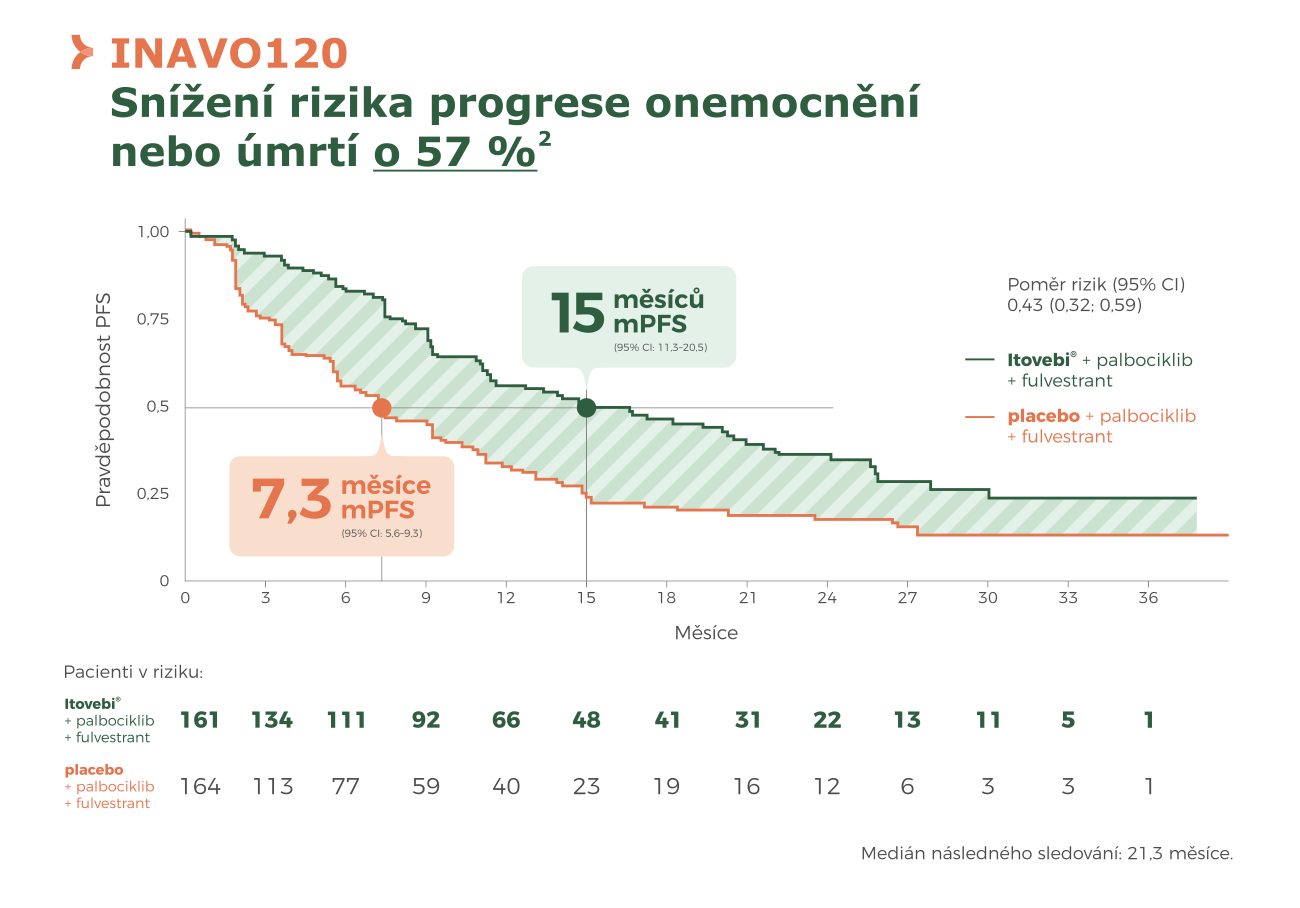
Klíčová data ze studie INAVO120
V randomizované studii INAVO120 kombinace Itovebi® + palbociklib + fulvestrant prokázala klinicky významný přínos oproti placebu + palbociklib + fulvestrant u pacientů s HR+/HER2– mBC, s primární nebo sekundární rezistencí a mutací PIK3CA2,3:
● Celkové přežití (OS): medián 34,0 měsíce vs 27,0 měsíce; poměr rizik 0,67 (95% CI 0,48–0,94), tj. prodloužení mOS o 7 měsíců3.
● Přežití bez progrese (PFS): medián 15 měsíců vs 7,3 měsíce; poměr rizik 0,43 (95% CI 0,32–0,59), což odpovídá snížení rizika progrese nebo úmrtí o 57 %2,3.
Co to znamená pro klinickou praxi?
Itovebi® umožňuje cíleně zasáhnout PI3K dráhu u pacientů s endokrinně rezistentním HR+/HER2– mBC už v první linii systémové léčby1,2. Zásadní podmínkou je prokázaná mutace PIK3CA, proto by mělo být její vyšetření součástí rozhodování o 1. linii léčby metastatického onemocnění1,2.
▼Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky prostřednictvím webového formuláře sukl.gov.cz/nezadouciucinky, případně na adresu: Státní ústav pro kontrolu léčiv Šrobárova 49/48 100 00 Praha 10 e-mail: farmakovigilance@sukl.gov.cz. Tato informace může být také hlášena společnosti Roche na czech_republic.pa_susar@roche.com nebo +420 602 298 181. Podrobné informace o dávkování, kontraindikacích a bezpečnostním profilu jsou uvedeny ZDE1.
Bližší informace najdete ZDE 2-4.
REFERENCE: 1. SPC Itovebi. 2. Turner NC, et al. N Engl J Med 2024; 3. Jhaveri KL, et al. N Engl J Med 2025. 4. Juric D, et al. ASCO 2024 (Oral 1003).
M-CZ-00005275


