Kabozantinib v léčbě diferencovaných karcinomů štítné žlázy
Doc. MUDr. Kateřina Kopečková, Ph.D., Onkologická klinika 2.LF UK a FN Motol.
Kabozantinib rozšiřuje možnosti léčby diferencovaného karcinomu štítné žlázy, zejména u pacientů s radiojod-refrakterním onemocněním. Nové klinické studie i zkušenosti z praxe potvrzují jeho účinnost a přínos v druhé a třetí linii terapie. Zajímá Vás, jak kabozantinib ovlivnil průběh onemocnění u jednotlivých pacientů a jaké byly jejich léčebné odpovědi? Přečtěte si celý článek s kazuistikami.
Úvod
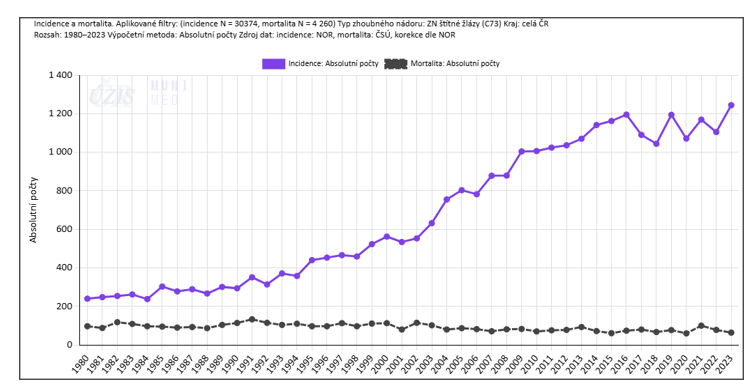
V České republice se výskyt karcinomů štítné žlázy od počátku 80. let zvýšil čtyřikrát. V roce 2023 bylo v České republice diagnostikováno nově 1244 případů nádorů štítné žlázy, oproti 262 případům v roce 1983 (obrázek 1-3). Dochází též k jednoznačnému nárůstu nově diagnostikovaných nemocných v prvním stádiu. Vysoký nárůst incidence je též dáván do souvislosti s lepší dostupností diagnostických metod. Zároveň dochází k prodloužení přežívání nemocných s touto diagnózou, včetně nemocných s metastatickým onemocněním. Diferencované karcinomy štítné žlázy (DTC) jsou nejčastějšími malignitami, následované, medulárním karcinomem a anaplastickým karcinomem a primárními lymfomy štítné žlázy. Nejčastějšími histologickými typy jsou papilární karcinom, který představuje 84% všech nádorů štítné žlázy, následuje folikulární karcinom 4%, onkocytární karcinom 2%, dediferencovaný karcinom 5%, anaplastický karcinom 1% a medulární karcinom 4%. Více jak 80% nádorů je menší než 2 cm a v minulosti nebyly často vůbec diagnostikovány.
Obrázek č.1-3.
U 5%-10% nemocných s diagnózou karcinomu štítné žlázy dojde k vývoji metastatické choroby. Základem léčby je resekce tumoru následována u vysoce rizikových karcinomů aplikací radiojodu (RAI). U 5-10% nemetastatických DTC se vyskytne refrakterita na radiojod ( RAI-R) a u metastatických DTC až 50% nemocných vyvine RAI-R. Jako radiojod refrakterní (RAI-R) tumory definujeme nádory bez vychytávání jódu s minimálně jednou měřitelnou lézí nebo nádory, u kterých dochází k progresi choroby do 12 měsíců od aplikace RAI nebo perzistence choroby po léčbě RAI s kumulativní dávkou více jak 600mCI. Takovéto nádory se nejčastěji vyskytují u starších nemocných, často se jedná o špatně diferencované či dobře diferencované tumory s přítomností nekrózy, s velkou nádorovou masou a vysokou akumulací FDG ( fluoro- deoxyglukózy) při PET vyšetření.
Nové poznatky v oblasti nádorové biologie a genetiky otevřely možnosti vývoje nových léčebných molekul cílené tumor-agnostické terapie i pro tento vzácný typ nádorů. Pro léčbu diferencovaných RAI-R karcinomů jsou již několik let používány inhibitory tyrosinkináz - sorafenib a lenvatinib. Kabozantinib byl v roce 2022 registrován též pro léčbu diferencovaných karcinomů u nemocných, kteří podstoupili již jednu nebo dvě linie systémové terapie. Pro nádory s alterací RET genu je registrován selperkatinib, léčivé přípravky larotrektinib a entrektinib jsou registrovány pro nádory s NTRK fúzními geny s vyčerpanou standardní léčbou (obrázek č.4).
Obrázek č.4
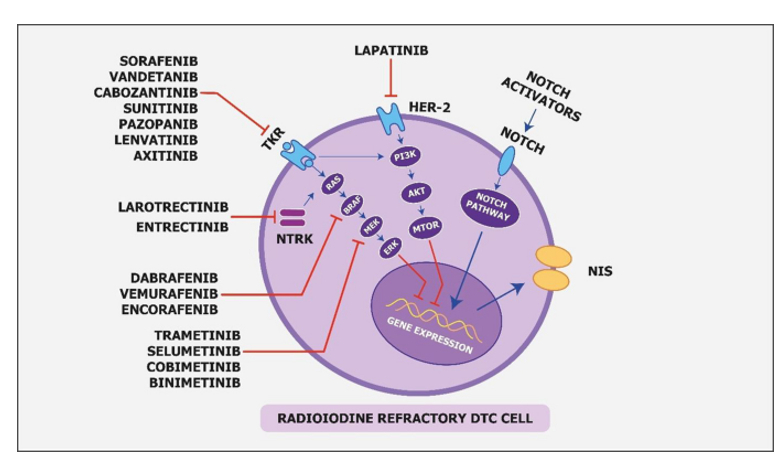
Kabozantinib je malá molekula, která inhibuje více receptorových tyrozinkináz (RTK) zapojených do růstu tumoru a angiogeneze, patologického remodelování kostí, lékové rezistence a metastatické progrese nádorového onemocnění. U kabozantinibu byla prokázána inhibiční aktivita vůči MET (receptorový protein růstového faktoru hepatocytů) a VEGF (vaskulární endoteliální růstový faktor) receptorů. Kabozantinib navíc inhibuje jiné tyrozinkinázy včetně receptoru GAS6 (AXL), RET, ROS1, TYRO3, MER, receptoru pro faktor kmenových buněk (KIT), TRKB, tyrozinkinázu-3 typu Fms (Fms-like tyrosine kinase-3 .
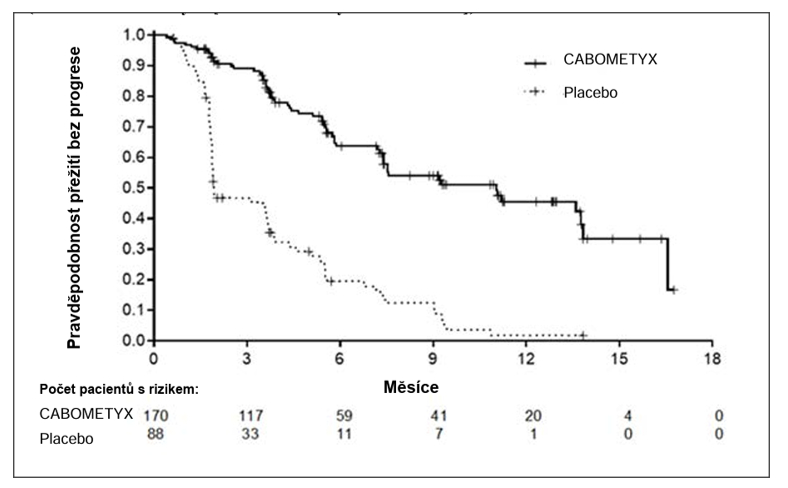
Bezpečnost a účinnost přípravku CABOMETYX byla v hodnocena v randomizované (2:1), dvojitě zaslepené, placebem kontrolované, multicentrické studii (COSMIC-311) u dospělých pacientů s lokálně pokročilým nebo metastazujícím diferencovaným karcinomem štítné žlázy, který progredoval po maximálně dvou předchozích terapiích cílených na VEGFR (lenvatinibu nebo sorafenibu) a byl rezistentní vůči radioaktivnímu jódu nebo pacient vhodný k léčbě radioaktivním jódem. Pacienti s měřitelným onemocněním a dokumentovanou radiografickou progresí byli randomizováni (n=258) k podávání kabozantinibu v dávce 60 mg perorálně jednou denně (n=170) nebo placeba (n= 88). Stratifikačními faktory bylo podání lenvatinibu (ano vs. ne) a věk (≤ 65 let vs. > 65 let). Primárními ukazateli výsledné účinnosti bylo přežití bez progrese (PFS) a výskyt objektivní odpovědi (ORR). Celkové přežití (OS) bylo dalším cílovým parametrem studie. Histologicky mělo 55 % potvrzenou diagnózu papilárního karcinomu štítné žlázy, 48 % mělo folikulární karcinom štítné žlázy, včetně 17 % pacientů s karcinomem štítné žlázy z Hürthleových buněk. Metastázy byly přítomny u 95 % pacientů: v plicích u 68 %, v lymfatických uzlinách u 67 %, v kostech u 29 %, na pohrudnici u 18 % a v játrech u 15 %. Pět pacientů nedostalo předchozí RAI z důvodu nezpůsobilosti, 63 % dříve dostávalo lenvatinib, 60 % dříve užívalo sorafenib a 23 % užívalo sorafenib i lenvatinib. Medián doby léčby byl 4,4 měsíce v rameni s kabozantinibem a 2,3 měsíce v rameni s placebem. Výsledky studie jsou uvedeny v tabulce č. 1. Studie prokázala statisticky významné zlepšení PFS (medián sledování 6,2 měsíce) u pacientů randomizovaných k léčbě kabozantinibem (n=125) ve srovnání s placebem (n=62) (graf č.1).
Tabulka č.1: Výsledky účinnosti
.png)
Graf. č. 1 Kaplan-Meierova křivka Přežití bez progrese (PFS) ve studii COSMIC-311
Zkušenosti s léčbou pacientů na Onkologické klinice Fakultní nemocnice v Motole.
Kazuistika č.1
Nemocná podstoupila ve věku 59 let v roce 2013 totální thyreoidektomii pro papilární karcinom štítné žlázy s následnou aplikací radiojodu. V roce 2015 byly zjištěny plicní metastázy. Nemocná byla též sledována pro revmatoidní artritidu. V lednu 2000 jsme zahájili léčbou sorafenibem v dávce 800 mg denně pro radiojod refrakterní PTC s progredujícími plicními metastázami. 5.den terapie se objevil toxo-alergický exanthém stupně 3, proto terapie byla přerušena. Po odeznění nežádoucích účinků jsme reiniciovali terapii v redukované dávce 600 mg denně. Po dalších 3 dnech došlo opět k rozvoji toxo-alergického exanthému, proto terapie sorafenibem byla ukončena a zahájena léčba lenvatinibem v dávce 24 mg denně. V druhém týdnu terapie lenvatinibem se objevuje hypertenze s nutností zahájení antihypertenzní terapie. Dávka lenvatinibu byla redukována na 20 mg denně. Z nádorové tkáně bylo provedeno NGS (Next Generation Sequencing), které neprokázalo přítomnost targetabilní genomické alterace. Během terapie lenvatinibem dochází k exacerbaci revmatoidní arthritidy a nutnosti zahájení terapie antimetabolitem methotrexátem. Při prvním přešetření dochází k progresi plicních metastáz, objevuje se nové osteolytické kostní metastázy a metastáza v měkkých částech krku. Léčba lenvatinibem ukončena. Následně provedeno ozáření metastázy v oblasti krku a symptomatické kostní metastázy levého humeru. Dva měsíce po skončení radioterapie humeru dochází v tomto terénu k patologické fraktuře. Pro přítomnost kostních metastáz zahájena antiresorpční terapie denosumabem. U nemocné dochází rozvoji neurologické symptomatologie ve smyslu nestability a parézy horní končetiny. Provedená MR mozku prokázala solitární mozkovou metastázu ve frontálním laloku, pro kterou nemocná podstoupila stereotaktickou radioterapii. Na kontrolní MR mozku 4 měsíce po radioterapii se objevují další mozkové metastázy, které též ošetřeny stereotaktickou radioterapií. Kontrolní PET/CT prokázal další progresi plicních metastáz a nové kostní léze. Proto v říjnu 2022 byla zahájena další linie léčby kabozantinibem. Iniciální dávka pro předchozí toxicitu byla redukována 40 mg. Na této dávce i s dobrou tolerancí dochází ke stabilizace extrakraniálního metastatického postižení. Postupně ovšem dochází ke zhoršování neurologického nálezu, progrese paraparézy, stability, která vedla k ukončení terapie kabozantinibem po 8 měsících terapie bez prokázané progrese.
Kazuistika č. 2
U 70-ti letého nemocného pro rychle progredující strumu provedena tenkojehlová biopsie s podezřením na karcinom. Následovala v září 2019 hemithyreoidektomie s lymfadenektomií. Vzhledem k rozsahu infiltrace, nebyl možný radikální výkon, proto nebyla indikována terapie RAI a u nemocného bylo přistoupeno k radioterapii krku, která ukončena 3/2020. PET/CT vyšetření prokázala progredující generalizaci do plic a uzlin mediastina. Proto v září 2021 zahájena terapie sorafenibem v dávce 800 mg, která po týdnu musela být ukončena pro elevaci jaterních testů stupně 3. Po restituci jaterních funkcí pokračováno v systémové terapii lenvatinibem v redukované dávce 20 mg denně pro předchozí toxicitu. Pro špatně korigovatelnou hypertenzi a váhový úbytek byla nutná redukce lenvatinibu po 3 měsících terapie na 14 mg. Nadále nebyla možná optimální kontrola hypertenze a vzhledem ke stabilizaci metastatického procesu terapie lenvatinibem ukončena. Po dalších třech měsících dochází k výrazné progresi plicních metastáz, proto indikována 2. linie léčby kabozantinibem v iniciální redukci pro předchozí toxicitu 40 mg. Po 16 měsících terapie se objevuje gastrointestinální toxicita – průjmy, hubnutí. Došlo k přerušení terapie kabozantinibem a po odeznění nežádoucích účinků přistoupeno k reiniciaci v redukované dávce 20mg. Po týdnu užívání opět obtížně korigovatelné hypertenze, proto terapie ukončena. Léčba kabozantinibem komplikována rozvojem osteonekrózy mandibuly. Tři měsíce po ukončení terapie prokázána dle PET jednoznačná progrese. V mezidobí provedená NGS prokázalo targetabilní mBRAFV600E. Vzhledem k dobrému klinickému stavu zahájena 3. linie terapie kombinací dabrafenibu s trametinibem. Po 3 měsících terapie dosaženo parciální remise, která po 6 měsících terapie přetrvává. Léčba je dobře tolerována.
Kazuistika č. 3
U 59- letého nemocného provedena biopsie rezistence v oblasti sterna s diagnózou metastázy onkocytární varianty folikulárního karcinomu štítné žlázy a následně totální thyreoidektomie, která potvrdila folikulární karcinom s angioinvazí. Následné PET/CT vyšetření prokázalo ložisko v játrech, proto následovala biopsie, která potvrdila metastázu známého karcinomu. Následovala resekce sterna, cholecystektomie a levostranná hemihepatektomie s odstraněním známých metastatických ložisek. Následně nemocný absolvoval terapii RAI. Dva roky po chirurgickém zákroku prokázána progrese metastáz v játrech a v měkkých částech krku, nález uzavřen jako RAI-refrakterní. V dubnu 2024 zahájena terapie sorafenibem v dávce 800 mg denně s dobrou tolerancí. Po 7 měsících terapie prokázána progrese onemocnění v játrech. Proto změna terapie na lenvatinib 24 mg denně. Nejlepší léčebné odpovědi dosaženo po 7 měsících terapie ve smyslu parciální léčebné odpovědi. V 13 měsících terapie nemocný byl akutně hospitalizován pro bolesti na hrudi a prokázána srdeční ischémie. Na rozvoji kardiální ischemie se mohla podílet i přítomná ateroskleróza, proto po stabilizaci stavu byla terapie reiniciována v redukované dávce 14mg. Po dalších 12 měsících terapie dochází k progresi jaterních i kostních metastáz, proto terapie ukončena. Provedené NGS prokázalo mutace PIK3CA a NRAS. V květnu 2024 zahájen 3. linie terapie kabozantinibem v redukované dávce 40 mg pro předchozí anamnézu kardiální ischémie. Zároveň provedena analgetická radioterapie symptomatické kostní metastázy pravého acetabula. Nemocný umírá náhle po 2 měsících terapie na rozsáhlou plicní embolii.
Kazuistika č. 4
63- letý nemocný byl odeslán pro strumu k provedení thyreoidektomie. Ve svých 35 letech podstoupil chemoterapii a radioterapii krku pro imunoblastický lymfom. O 20 let později mu byl diagnostikován velkobuněčný lymfom varlete, pro který byl léčen systémovou chemoterapií radioterapií varlete. Totální thyreoidektomie byla provedena v únoru 2022 s nálezem papilárního karcinomu štítné žlázy. V květnu 2022 již s nálezem rezidua v oblasti lůžka po thyreodektomii následovala aplikace RAI. Po 3 měsících byl akutně hospitalizován pro hemoptýzu s nálezem lokální inoperabilní recidivy s infiltrací trachey a stěny jícnu. Nemocný zahájil terapii lenvatinibem s rychlým nástupem efektu léčby během několika dnů. Na této terapii dochází k výrazné regresi nálezu. Nicméně po 3 měsících terapie se objevuje opět rozsáhlá lokální recidiva provázená hemoptýzou, dysfágií a zároveň diagnostikována generalizace do skeletu a plic. Na základě vyšetření NGS s prokázanou fúzí RET genu jsme zahájili terapie selperkatinibem, cíleným RET inhibitorem. Opět dochází k výraznému a rychlému efektu cílené terapie po několika dnech. Po 13 měsících terapie selperkatinibem se objevuje lokální recidiva v místě krku. V lednu 2024 provedena neradikální exstirpace rychle progredující metastázy v oblasti krku. Genomická analýza prokázala kromě selperkatinib senzitivní genové fúze CCD6:RET i patogenní variantu G810C v genu RET spojenou s rezistencí k terapii selperkatinibem. Vzhledem k neradikalitě výkonu indikována reradioterapie krku v dávce 50 Gy protonovým svazkem. Před zahájení radioterapie nemocnému zaveden preventivně PEG. V březnu 2024 dochází k progresi plicních metastáz, proto jako další linie léčby indikován kabozantinib v dávce 40 mg pro obtížně korigovatelnou hypertenzi při terapii selperkatinibem. Na základě dat o možné dediferenciaci po terapii TKI, byl indikován RAI. Metastatický proces však neakumuloval RAI. Na kontrolní CT prokázána výrazná progrese onemocnění s karcinomatózou pleury. Léčba kabozantinibem po dvou měsících ukončena. Jako další možnost léčby zvažován everolimus na základě mezinárodních doporučení. Nicméně další rychlá progrese nádorového procesu vede k úmrtí nemocného měsíc od ukončení terapie kabozantinibem.
Kazustika č. 5
Nemocný podstoupil hemithyreoidektomii pro zjištěný papilární karcinom v roce 2014 s následnou aplikací RAI. Po třech letech mu byla exstirpována uzlinová metastáza na krku. V roce 2018 byla prokázána generalizace do plic a recidiva na krku. Pro stabilizaci plicních metastáz s izolovanou progresí krční metastázy jsme provedli v lednu 2020 ozáření krku. 6 měsíců od skončení radioterapie krku dochází k jednoznačné progresi plicních metastáz, proto zahájena terapie sorafenibem v dávce 800 mg denně. Pro rozvoj kožní toxicity stupně 2, dávka redukována na 600 mg . Na této terapii bylo dosaženo stabilizace onemocnění, jako nejlepší léčebné odpovědi. Po 10 měsících léčby dochází k jednoznačné progresi, proto tato terapie ukončena a zahájena terapie lenvatinibem v dávce 24 mg denně. Pro vývoj hypertenze byla nutná redukce dávky lenvatinibu na 20 mg. První restaging prokázal parciální léčebnou odpověď. Po 20-ti měsících terapie dochází k progresi onemocnění. Vzhledem k absenci biologického materiálu pro NGS provedena exstirpace uzlinové krční metastázy. Nicméně biologický materiál neprošel kontrolou kvality pro genomické testování. Od února 2024 zahájena druhá linie terapie kabozantinibem v redukované dávce 40 mg pro předchozí výskyt toxicity TKI – kožní a hypertenze. Na prvním restagingu po třech měsících dochází k regresi metastatického uzlinového postižení. Po 9 měsících terapie se objevují vícečetné kostní metastázy, proto terapie kabozantinibem ukončena. Následně proveden EBUS s cílem verifikace plicního procesu, který budil podezření na duplicitní primární plicní neoplázii. Histologicky prokázána metastáza karcinomu štítné žlázy s patologickou variantou PTEN a TP53. U nemocného dochází k další rychlé progresi plicního postižení a nemocný umírá 6 měsíců po skončení terapie kabozantinibem.
Kazuistika č. 6
U 65- letého nemocného byla v roce 2018 provedena totální thyreoidektomie pro papilo-folikulární karcinom štítné žlázy s prokázanými metastázami do plic. V anamnéze jsou další malignity. V roce 1993 podstoupil pooperační chemoterapii a radioterapii pro liposarkom třísla. Po 9 letech se objevila lokální recidiva dediferencovaného liposarkomu, která byla radikálně odstraněna. Třetí malignitou v anamnéze je papilární karcinom ledviny, pro který byla provedena radikální nefrektomie v roce 2012. Po thyreoidektomii opakovaně aplikován RAI. Pro rychlou progresi měkkotkáňové rezistence v oblasti l. paže provedena biopsie, která prokázala metastázu karcinomu štítné žlázy. Následovala paliativní radioterapie této metastázy a vzhledem k progresi kostního postižení zahájena terapie lenvatinibem v dávce 24 mg. Po 3 měsících terapie pro dyspepsii, průjem, nechutenství stupně 3 redukce dávky 20 mg. Po 13 měsících terapie prokázána progrese ve skeletu, objevují se nové jaterní metastázy. Proto indikována druhá linie terapie kabozantinibem v dávce 60 mg, která zahájena 7.7.2025.
Závěr
U diferencovaných RAI-R nádorů štítné žlázy je zásadní stanovit správný čas zahájení systémové terapie. Většina nemocných může být pouze sledována a terapie by měla být zahájena až při vysokém zdvojovacím čase a klinických obtížích. Velmi důležitá je též komunikace s nemocným, vysvětlení možností systémové terapie a edukace o toxicitě léčby. Standardem první linie léčby je sorafenib či lenvatinib, po sorafenibu v druhé linii může být podáván lenvatinib a v další linii kabozantinib. Kabozantinib je možno podávat v souladu s SPC ve druhé i třetí linii léčby. Ve druhé linii můžeme též zvážit tumor agnostickou terapii v případě přítomnosti targetabilní genomické alterace. Proto u nemocných vhodných k takového terapii bychom měli vždy po selhání první linie léčby indikovat provedení NGS. Léčba a diagnostika takovýchto vzácných nádorů vyžadující komplexní přístup napříč odbornostmi, by měla být centralizována do několika málo center v České republice a tak zajistit pro každého nemocného optimální terapie na základě současných znalostí.
Odkazy:
Petranović Ovčariček, P., de Keizer, B., Campennì, A. et al. Radioiodine-refractory thyroid cancer—is it time to change the definition in light of novel redifferentiation therapies?. Eur J Nucl Med Mol Imaging 52, 380–385 (2025)
SPC, CABOMETYX 20 mg, 40 mg nebo 60 mg potahované tablety, datum poslední revize textu: červenec 2025 www.ema.europa.eu/cs/documents/product-information/cabometyx-epar-product-information_cs.pdf